المحلل The Electrolyzer
المحلل هو جهاز يقوم بتحليل الماء إلى عناصره الأولية وهو عنصر أساسي في أنظمة خلايا الوقود المتصلة مع الخلايا الشمسية أو ما يسمى أنظمة
“هيدروجين – شمس”, تقوم هذه الأجهزة بتحويل الطاقة الكهربائية من الخلايا الشمسية إلى غاز الهيدروجين. ولها عدة أنواع : محللات ذات الضغط العالي, ذات الحرارة العالية, ذات الحرارة المنخفضة, ذات الضغط المنخفض, ذات الوسيط الصلب و ذات الوسيط السائل.
يفضل غالباً في أنظمة التوليد الهيدروشمسية الضغط المنخفض إلى المتوسط والحرارة المنخفضة والوسيط السائل, مقارنة التكلفة بالمحللات ذات الضغط المرتفع أو درجة الحرارة المرتفعة أو ذات الوسيط الصلب فهي غير مكلفه ومتوفرة ويسهل التعامل معها.
و كمقارنه سريعة بين الوسيط Electrolyte الصلب PEM والوسيط السائل نجد أن المحلل ذو الوسيط الصلب PEM(Proton Exchange Membrane) يمكن أستخدامه في الأنظمة الهيدرو-شمسية لتجنب استخدام الأوساط الكاوية , ومن مزاياه انه لا يحتاج إلى مراقبه مستمرة كما في الإلكترولايت السائل أما مساوئ المحللات PEM فهي غلاء سعرها ولا يمكن أن تعطي أي معلومات عن مرحله التحليل مثل المحللات السائلة التي يمكن أن نراقب مستوى السائل فيها. عامة التعامل مع محلل PEM يعتبر تقريباً خالي من أي مخاطر أو أخطاء وتبقى مشكلتها الأكبر هي استبدال أجزائها عند انتهاء فترة صلاحيتها. مثلا منها انفجار الغشاء (Membrane plow-out) أو انحلال الوسيط (Catalyst degeneration) كلا المشكلتين مكلفه لأننا نحتاج إلى استبدال هذه الأجزاء.
مبادئ المحلل (the Electroyzer) :
المحلل ذو الوسيط القلوي (الأساسي) كالمستخدم في أنظمة الهيدروجين شمس هو عنصر بسيط جدا يحلل الماء إلى عناصره الأساسية المكونة له الأكسجين والهيدروجين. يمكن تنفيذ هذا عبر إمرار تيار ذو توتر منخفض وتيار مستمر عالي نسبيا في وسيط قاعدي مثل محلول هيدروكسيد البوتاسيوم (KOH) و ماء مقطر.
يستخدم في عملية التحليل تيار كهربائي مستمر يتحرك باتجاه واحد فقط وهذا مهم لمبدأ عمل المحلل أما التيار المتناوب (Alternating Current (AC)) فلا يمكن استخدامه في عمليه التحليل الكهروكيميائي إلا في حال قمنا بتقويمه. يمكن استجرار التيار المستمر الذي يغذي المحلل من عده مصادر متجددة مثل الرياح أو الخلايا الشمسية أو من مولدات صغيره تعتمد على طاقة جوف الأرض ويمكن توليدها أيضا من مصادر غير متجددة مثل البطاريات الجافة أو من خلال تقويم التيار المتناوب العادي.
يتكون المحلل من قطبين (الكترودين tow Electrodes) غالبا مصنوعين من نيكل نقي أو من سبيكة خليط (نيكل – حديد) (Nickel Iron alloy) , ستانلس ستيل, ستانليس ستيل 316 (Monel) أو نيكل راني (Raney Nickel). أحد القطبين يوصل إلى القطب السالب من التغذية الكهربائية المستمرة والثاني يوصل إلى القطب الموجب. كلا القطبين مغمورين بمحلول هيدوكسيد البوتاسيوم في وعاء مغلق يحتوي أيضا على أنبوبي تجميع لتجميع الغاز الناتج, حيث يتكون غاز الهيدروجين عند القطب السالب أما غاز الأكسجين فيتكون عند القطب الموجب.
هناك عدة طرق لنحدد كمية الهيدروجين أو الأكسجين المتولد في المحلل ,أهمها :
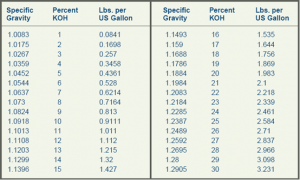
1- نسبة هيدروكسيد البوتاسيوم (KOH) إلى الماء في الوسيط داخل المحلل .
2- مساحة سطح القطبين .
3- المسافة بين القطبين .
4- كمية التيار المستمر من منبع التغذية .
النسبة العالية لهيدروكسيد البوتاسيوم إلى الماء تزيد النتاج لكن لحدود (29.4%)أي لو زادت النسبة عن هذا فان كمية الغاز الناتجة ثابتة تقريبا لأن تركيز الهيدروكسيد سيشكل ممانعة تمنع تشكل الغاز. أيضا كلما زادت مساحة القطب الفعالة زاد توليد الغاز لكن بالمقابل المساحة الأكبر تحتاج إلى تيار اعلى للاستفادة من المساحة المضافة, يمكن استنتاج علاقة تقريبية بين توليد الهيدروجين و كثافة التيار حيث إن كمية غاز الهيدروجين المتولد تتناسب مع التيار المغذي على مساحة القطبين , وتعطى بوحدة [ امبير على وحدة المساحة] وهو بارامتر مميز للمحل يعطى عادة مع المحللات المتوفرة بالسوق في حالة عملها المثلى (most efficient operation) .
أقطاب المحلل
1- الأقطاب ذات البنية المسامية :
غالبا ما تستخدم في المحللات الأقطاب المصنوعة من سبيكة ذات بنية مسامية مثل نيكل راني (Raney Nickel). حيث تصنع هذه السبيكة عبر خلط 50% ألمنيوم (Aluminum) و50% نيكل (Nickel) ثم يعالج الخليط بهيدروكسيد البوتاسيوم (Potassium Hydroxide) الذي يؤدي إلى تآكل الألمنيوم ويترك النيكل ببنية مسامية أسفنجية أو ما يسمى بنيكل راني (Raney Nickel) نسبة إلى العالم (Murray Raney) الذي اخترع هذه الطريقة. الأقطاب المصنوعة من هذه المادة تتمتع بمساحة كبيرة نظرا لبنيتها الأسفنجية كثيرة المسام وتنتج كمية اكبر من الغاز بقطب أصغر نسبة إلى قطب لا يتمتع بالبنية ذاتها كالأقطاب المصمتة أو الشبكية.
يعتبر نيكل راني ذو خصائص جيدة جدا لكنه أغلى من النيكل العادي و شبكة النيكل ذات البنية المسامية تعمل أيضا كمرشح للجزيئات الصغيرة. لكن الراسب المتكون مع الزمن يقلل من المساحة الفعالة للقطب وبالتالي من الغاز الناتج أي أن كفاءتها تنخفض مع الزمن.
2- الأقطاب ذات البنية الصفيحية :
يمكن زيادة المساحة للصفيحة عبر جعل سطحها أكثر خشونة (Sanding it) , وبالتالي يمكن زيادة الغاز الناتج. القطب الخشن العادي له سطح اقل من سطح القطب المصنوع من نيكل راني (Raney Nickel) لكن اكبر من مساحة القطب المصمت ويتميز أيضا بأنه رخيص ويمكن إعادة تشكيله بسهولة (Resanding) وبالتالي يمكن استخدامه لفترة أطول. يمكن جعل سطح القطب خشن عبر صقله باستخدام ورق زجاج (sand paper) خشن ونحركه بكل الاتجاهات لنحصل على اكبر سطح ممكن .
يستخدم أحيانا صفيحة (حديد-نيكل) (Iron-Nickel) تحتوي على 80% نيكل فهي تعتبر قطب جيد وغير مكلفة .
3- القطب ذو البنية الشبكية :
خيار أخر لأقطاب المحلل هو الأقطاب الشبكية فهي تؤمن مساحة أكبر من المساحة التي يؤمنها القطب المسطح (الصفيحة المصمتة) وهي ليست سهلة الانسداد كإسفنجه النيكل (Raney Nickel) .يمكن استخدام إما الستانلس ستيل (Stainless steel) 316 ,ستانليس ستيل 316 (Monel) أو رقاقة نيكل (Nickel Screen). رقاقة النيكل غالية لذا فان الستانليس ستيل 316 أو الستانليس ستيل هو الخيار الاقتصادي الأمثل حيث أن الستانليس ستيل 316 هو خليط (65% نيكل(Nickel) و 33% نحاس(Copper) و 2% حديد(Iron)) هذه السبيكة مقاومة للتآكل في الوسط القلوي وتعيش فيه لفترة طويلة .
4- مواد أخرى لجهاز التحليل :
من السهل بناء محلل ولكن من الصعب تصميم وبناء واحد من مواد جديدة لأن تلك العملية تحتاج إلى وقت طويل واعتبارات عديدة كنوع المادة المستخدمة للمساري. فبعض المعادن المستخدمة في صناعة المسرى الموجب هي النيكل المطلي بالمنغنيز, التنغستين أو أوكسيد الروثينيوم, هذه المعادن لها سرعة أكبر في التفاعلات القائمة عند المسرى الموجب. البلاتنيوم المطلي بالنيكل يمكن أن يستعمل كقطب سالب وذلك لزيادة إنتاج الهيدروجين. يمكن استخدام النيكل المطلي بالذهب أو بالبلاتنيوم للمسريين معاً أو أكسيد النيكل أيضاً. ويمكن أيضاً استخدام المعادن كالستانليس ستيل 316 (خليط أساسه النيكل) وذلك لسطحها المسامي الكبير و ثمنها الرخيص.على مدى التاريخ تم اختراع العديد من أشكال أجهزة التحليل ولكنها ليست ملائمة للاستخدام مع مصادر الطاقات المتجددة, تجدر الإشارة إلى أن المحلل ذو الأداء الأفضل ليس من الضرورة أن يكون المحلل الأمثل لكافة التطبيقات. أجهزة التحليل ذات الأداء الممتاز تحتاج إلى تكاليف بناء و صيانة عالية و المواد التي تبنى منها قليلة التوفر, الاختيار الأفضل هو الاختيار الوسط.
5- المسافة بين القطبين :
كلما صغرت المسافة بين القطبين كلما زادت غزارة توليد الغاز أكثر بالمقابل كلما صغرت المسافة بين القطبين زادت احتمالية مزج الغازين مع بعضهما حتى في وجود غشاء فاصل. بعض المحللات التجارية تستغني عن نقاء الغاز الناتج مقابل كفاءة أكبر للإستهلاك الكهربائي عند وضع القطبين قريبين من بعضهما, لكن في نهاية عملية التحليل وقبل استهلاك الغاز لابد من تنقيته بأجهزة تنقية خاصة غالباً ما تكون غالية وتلغي أي كفاءة اقتصادية للنظام. الحل الأكثر اقتصادية هو أن نزيد المسافة بين القطبين قليلاً ونضحي بالكفاءة الكهربائية قليلا.
كلمت زدنا التيار كلما ازداد إنتاج الغاز لكن لكل نظام كهربائي قيم تيار وتوتر محددين فإذا زادت التغذية عن هذه القيمة سيؤدي إلى تدهور الإنتاج أو تخريب الآلة. أقل توتر دخل لازم هو ما بين (1.29 إلى 1.49)فولت حيث أن هذه القيمة لازمة لعملية تحليل جزيء الماء إلى هيدروجين وأكسجين.
الوسيط (The Electrolyte)
هيدروكسيد البوتاسيوم يعتبر وسيط قوي هذا يعني أنه كمحلول متأين (مشرد) بشكل كامل 100% لذا فهو موصل جيد للكهرباء فعند توصيل القطب الموجب والسالب إلى مصدر كهرباء مستمر يرتبط أيون الهيدروجين مع إلكترون عند القطب السالب لينتج غاز الهيدروجين وأيون الهيدروكسيد يتخلى عن إلكترون عند القطب الموجب ويتكون غاز الأوكسجين وتكون كمية الهيدروجين الناتجة ضعف كمية الأوكسجين نظرا لكون جزيء الماء مكون من ذرتي هيدروجين لكل ذرة أكسجين.
يمكن استخدام أوساط أخرى مثل هيدروكسيد الصوديوم (Sodium Hydroxide) لكنها ليست ناقلة بكفاءة هيدروكسيد البوتاسيوم (KOH).يمكن أيضا استخدام الأحماض مثل حمض السلفاريك (Sulpharic-acid) لكنها ستؤثر بشكل اكبر على الأقطاب ويفتتها كما يؤثر سلبا على الأسلاك والعناصر التي يلامسها لذا لا يستخدم غالبا.
إذا هيدروكسيد البوتاسيوم هو أفضل اختيار للمحلل كوسيط قلوي .يمكن الحصول على (KOH) أو يمكن صناعته من رماد الخشب و بعض المواد المنزلية.
يمكن قياس نسبة هيدروكسيد البوتاسيوم بالمحلول في وعاء التحليل بواسطة مقياس Hydrometer. و يمكن غلي المحلول لزيادة تركيزه أو إضافة مياه مقطرة للحصول على محلول أخف .
ربط الأنظمة الكهروشمسية مع المدخرات و المحلات:
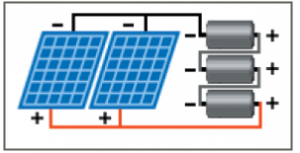
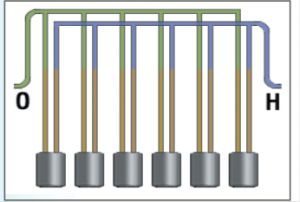
النظم الكهروشمسية الموصلة مع نظام المدخرات تعطي كموناً أعلى من التيار حيث تطلق الألواح الشمسية تياراً يتراوح بين 2 إلى 10 أمبير وهو تيار القصر و توتراً يتراوح بين 16 إلى 18 فولتاً وهو توتر الدارة المفتوحة. إن الأنظمة الكهروشمسية الموصولة مع مدخرات تصمم عادة بخرج قيمته 12 فولت وذلك من أجل شحن مدخرات الـ 12 فولت و هي مناسبة لتشغيل مجموعة من أجهزة التحليل الموصولة على التسلسل. أي في حال لدينا مجموعة من اللواقط الشمسية كل منها له توتراً قيمته 15 فولتاً وذلك عند تيار 10 أمبير, فيمكننا بواسطة لاقطين شمسين موصلين على التسلسل تشغيل 3 محللات عند توتر 4 فولت لكل محلل وتيار 20 أمبير كما في الشكل:
أجهزة التحليل الموصولة على التسلسل:
في حالة مجموعة من أجهزة التحليل الموصولة على التسلسل و للحصول على قيمة توتر الخرج المطلوبة من اللواقط الشمسية يجب جمع قيمة التوتر اللازم لكل محلل مضاف إلى المجموعة و في حالة الرغبة في تشغيل المجموعة عند تيار أعلى يجب وصل لواقط على التفرع. الميزة من وصل المجموعة بشكل تسلسلي هي استخدام خزان واحد من هيدروكسيد البوتاسيوم وتوافر لوحات بقيم خرج مماثلة. سيئة التركيبة السابقة للمحللات أنه في حال خروج أحد أجهزة التحليل من العمل تخرج باقي أجهزة التحليل أي في حال الرغبة في إجراء عملية الصيانة على أحدها سوف نضطر إلى إيقاف عمل المجموعة كاملةً و في حال انخفاض أداء أحد أجهزة التحليل يؤثر ذلك على أداء المجموعة وأيضاً تحتاج المجموعة إلى كمية كبيرة من هيدروكسيد البوتاسيوم و بشكل عام أجهزة التحليل الموصلة على التسلسل أقل فعالية من أجهزة التحليل الموصلة على التفرع.
إعداد مجموعة أجهزة التحليل :
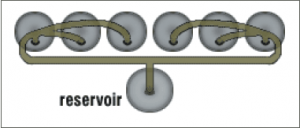
في حال استخدام نظام كهروشمسي مع حوض هيدروكسيد بوتاسيوم مشترك بحيث يخرج التيار ومحلول هيدروكسيد البوتاسيوم من أحد أجهزة التحليل ويدخل الأخر, كمثال على ذلك و في حال لدينا نظام كهروشمسي بخرج 12 فولت و 10 أمبير موصول على التفرع-التسلسل (أي زوج من الخلايا موصولين مع بعضهما على التفرع موصول مع زوج أخر على التسلسل) وذلك للحصول على توتر 4 فولت و تيار 20 أمبير لكل محلل نقوم بالتشكيلة كما في الشكل:
ويجب توصيل أنابيب خروج الغاز مع مراعاة عدم نفاذ هيدروكسيد البوتاسيوم من احد الأنابيب إلى الأخر عن طريق استخدام أنابيب ذات ارتفاع مناسب كما هو مبين بالشكل:
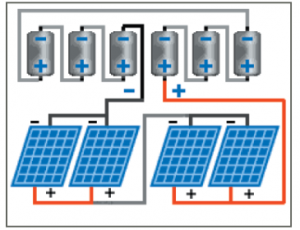
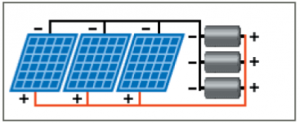
أجهزة التحليل الموصلة على التفرع :
أجهزة التحليل الموصلة على التفرع (والتي تدعى أيضاً بأجهزة التحليل الأحادية القطبية) توصل بالشكل التالي:
هذا النوع من التوصيل لا يستخدم في الأنظمة الكهروشمسية المخصصة للاستخدام مع المدخرات وذلك لأنه يقدم لكل محلل توتراً كبيراً ولكن ميزة هذه الطريقة في الوصل هي فعاليتها العالية فعند وصل أجهزة التحليل تفرّعياً لا تتأثر أحد أجهزة التحليل بعمل باقي المجموعة ويمكن تبديل أحد أجهزة التحليل أثناء عمل النظام دون أن يؤثر ذلك على عمل النظام والميزة الأخرى لطريقة التوصيل هذه هي أن لكل محلل وعاء هيدروكسيد البوتاسيوم الخاص به.
إن الوصل التفرعي يحتاج إلى مجموعة كهروشمسية بتوتر أقل و لكن تيار أعلى, على سبيل المثال فعند الرغبة في تغذية ثلاثة محللات بتوتر 4 فولت و تيار 20 أمبير يجب أن يكون لدينا نظام بخرج 4 فولت و تيار 60 أمبير لتغذيتها أي نحتاج إلى ثلاثة ألواح لكل منها خرج 4 فولت و تيار 20 أمبير موصولة على التفرع.
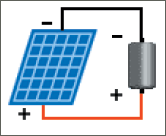
العمل بالوضع الافرادي :
الوضع الافرادي هو أن يكون لكل محلل منبع تغذية و توصيلاته الخاصة به بالإضافة لحوض هيدروكسيد البوتاسيوم وأنابيب الغاز الخاصة به وتنتهي فقط وصلات أنابيب الغاز الناتج إلى خزان واحد.يحتاج كل محلل في حالة العمل الافرادي إلى منبع شمسي وحيد بخرج 4 فولت و 20 أمبير.
مقارنة بين جهاز تحليل واحد كبير وعدة أجهزة تحليل صغيرة:
عند تصميم نظام هيدروجين شمسي (نظام هجين) يجب أن نحدد أيهما أكثر فعالية إذا استخدمنا مجموعة من أجهزة التحليل الصغيرة أو استخدام محلل واحد كبير أو محللين. غالباً ما يكون استخدام محللات كبيرة أكثر فعالية واقتصادية من استخدام مجموعة محللات صغيرة ولكنها ليست قاعدة عامة. فعند بناء محلل أكبر كل ما نقوم بفعله هو بناء محلل مماثل للمحلل الصغير ولكن بأبعاد أكبر ولكن بتكبير أبعاد المحلل يجب أن نأخذ بعين الاعتبار زيادة التيار وبالتالي نحتاج لأسلاك كهربائية مناسبة مع هذا التيار (ذات مقطع أكبر) كي لا تتبدد الاستطاعة على شكل حرارة في الوصلات, أيضاً عند تمرير تيارات أكبر ترتفع لدينا درجة الحرارة في الوصلات وهو أمر مهم عند التعامل مع الهيدروجين. لذا دائماً يفضل في الأنظمة المخبرية بناء محلل صغير مناسب لإجراء التجارب.
التطبيق العملي :
اختبار أداء المحلل:
المحلل القلوي غالباً ما يعمل عند توترات بين 1.6 و 2.3 فولت وبقيمة وسطية 1.8 فولت وتيار حوالي 20 أمبير ويعطي مردود كهربائياً بين 54% إلى 78% . أجهزة التحليل التي تعمل عند درجة حرارة و ضغط مرتفعتين تعني تكاليف صيانة وإنشاء أكبر ولكنها تعمل عند توترات بين 1.3 و 1.7 فولت وبمردود كهربائي بين 73% إلى 95%. التوتر الأقل يعني تيار دخل أقل ويعني إنتاج غاز أقل من حالة جهاز التحليل القلوي عند الضغط و الحرارة المنخفضتين وذلك مع أنه في الحالة الثانية كان المردود الكهربائي أعلى. هناك علاقة بين التوتر وكثافة التيار حيث أنه كلما احتجنا إلى كثافة تيار أكبر احتجنا إلى منبع بتوتر أكبر. ولقياس المردود الكهربائي للمحلل نقوم بقياس التيار الذي يستجرّه المحلل وهو في حالة العمل ونقيس التوتر بين قطبي المحلل ونضرب الناتج فنحصل على الاستطاعة المتسجرّة من المنبع ولقياس المردود الكهربائي نقوم بتقسيم 1.24 على قيمة التوتر المقاسة في لحظة القياس. على سبيل المثال في حال حصولنا على قراءة 1.8 فولت عند تيار 16 أمبير عندها يعمل المحلل عند استطاعة 28.8 واط وبتقسيم 1.24 على 1.8 نجد أن المردود الكهربائي للمحلل حوالي 69%.
جمع معلومات الأداء عند العمل مع مصادر الطاقات المتجددة:
في معظم أنظمة الطاقات المتجددة يتغير التوتر والتيار بشكل مستمر تبعاً للظروف الجوية لذلك نقوم بقياس التغير في الدخل (الإشعاع الشمسي مثلاً) تبعاً للفصل ونقيس أداء المحلل وبالتالي نحصل على منحني للأداء تبعاً للفصل.
تجريب التجهيزات:
يمكن تخزين نتائج التجارب الميدانية على حاسب وذلك عن طريق وصل المقاييس المناسبة مع التجهيزات ويجب مراعاة إعدادات أجهزة القياس كي تتلاءم مع القيمة المراد قياسها للحصول على قراءات تيار دقيقة. ويمكن أيضاً الاختبار كمقاربة بين قيم الدخل (تيار وتوتر) وقيم الخرج (كحجم غاز).
قياس الغاز الناتج:
يمكن قياس حجم وتدفق وضغط الغاز بعدة طرق حيث يمكن استخدام مقاييس الضغط والغزارة للحصول على القيم المطلوبة أو يمكن أيضاً وضع دلو (ثلاثة غالونات) في دلو من الماء (خمسة غالونات) للحصول على خزان غاز طافي وعلى الرغم من عدم دقة هذه الطريقة إلا أنها تعطي فكرة عن كمية الغاز الناتج في أوقات محددة وذلك عند قيم تيار وتوتر محددة.
معادلات حساب كميات الغاز:
هناك معادلات خاصة لحساب كميات الغاز الناتج عند الشروط المثالية (درجة حرارة 25 C أو 298 K وضغط واحد جو أول 101.3 kPa) وهي عملية للتحقق من القيم المقاسة بأجهزة القياس. على سبيل المثال لقياس قيمة الهيدروجين أو الأكسجين الناتج خلال ساعة نقوم أولاً بقياس التوتر على مرابط المحلل أثناء العملية وبعدها نقوم بقياس قيمة التيار وبعدها نقوم بضرب القيمتين السابقتين مع بعضهما لنحصل على استطاعة الدخل, عند توتر 2 فولت وتيار 20 أمبير تكون قيمة الاستطاعة المسحوبة من قبل المحلل 40 واط ,وبعدها نقوم بتحويل القيمة المقاسة من وات إلى جول (حيث أن الجول هو واط لكل ثانية) أي في حالة الاستعمال لساعة يستجر المحلل 40*3600 جول في الساعة أي ما يعادل 144 كيلو جول بالساعة.
إن ليتر واحد من الماء ينتج 1358.3 ليتر من الهيدروجين و 679.15 ليتر من الأوكسجين ونحتاج إلى 13170.9 كيلو جول من أجل تحليل ليتر واحد من الماء ولذا نقوم بتقسيم 13170.9 كيلو جول على 144 كيلو جول فنحصل على الوقت اللازم للحصول على نتائج تحليل ليتر واحد من الماء أي 91.46 ساعة ولمعرفة كمية الهيدروجين المنتجة خلال ساعة واحد نقوم بتقسيم كمية الهيدروجين المنتجة من تحليل ليتر واحد من الماء (1358.3) على عدد الساعات اللازمة لتحليل ليتر واحد من الماء (91.46) ساعة. النتيجة تعبر عن عدد الليترات المنتجة خلال ساعة واحدة وفي نظامنا هذا تكون 14.85 ليتر من الهيدروجين في الساعة. وبطريقة مماثلة نقوم بعملية الحساب نفسها من أجل حساب كمية الأوكسجين الناتجة في الساعة. وللحصول على القيم بالقدم المكعبة نقوم بتقسيم عدد الليترات على 28.317 .وبالنسبة لنظام أجهزة تحليل موصل مع نظام كهروشمسي يمكن معرفة قيمة الدخل عن طريق الخرائط الشمسية و التي تحدد قيمة الإشعاع الشمسي للمكان المركبة فيه من العالم.
المصادر:
P. Hurley, How to build a Solar Hydrogen Fuel Cell System


افضل بحث استمعت ان اصل اليه حتى الان
شكرا مهندس اسامه
معلومات علميه وعمليه قيمه ويعطيكو العافيه
البحث كان شيقا ومشوقا الله يجزي عنا كل خير لمن يساهم في نشر العلمولكن السؤال الغاز المستخدم ماهو هل الهيدروجين فقط
كماذكر في البحث الغازات الناتجة من تحليل الماء هي غاز الهيدروجين والاكسجين ويمكنك أستخدام كلاهما